بسمه تعالی
می شنوم و فراموش می کنم می بینم و به خاطر می آورم انجام می دهم و می آموزم
عناوین فعالیت های قابل اجراء در دوره ی برگزاری مسابقات آزمایشگاهی سا ل 89 – 88 در منطقه ی شا ل
ردیف | عنوان فعالیت |
1 | بیان نکات ایمنی در آزمایشگاه |
2 | آشنایی با علامت های هشدار دهنده |
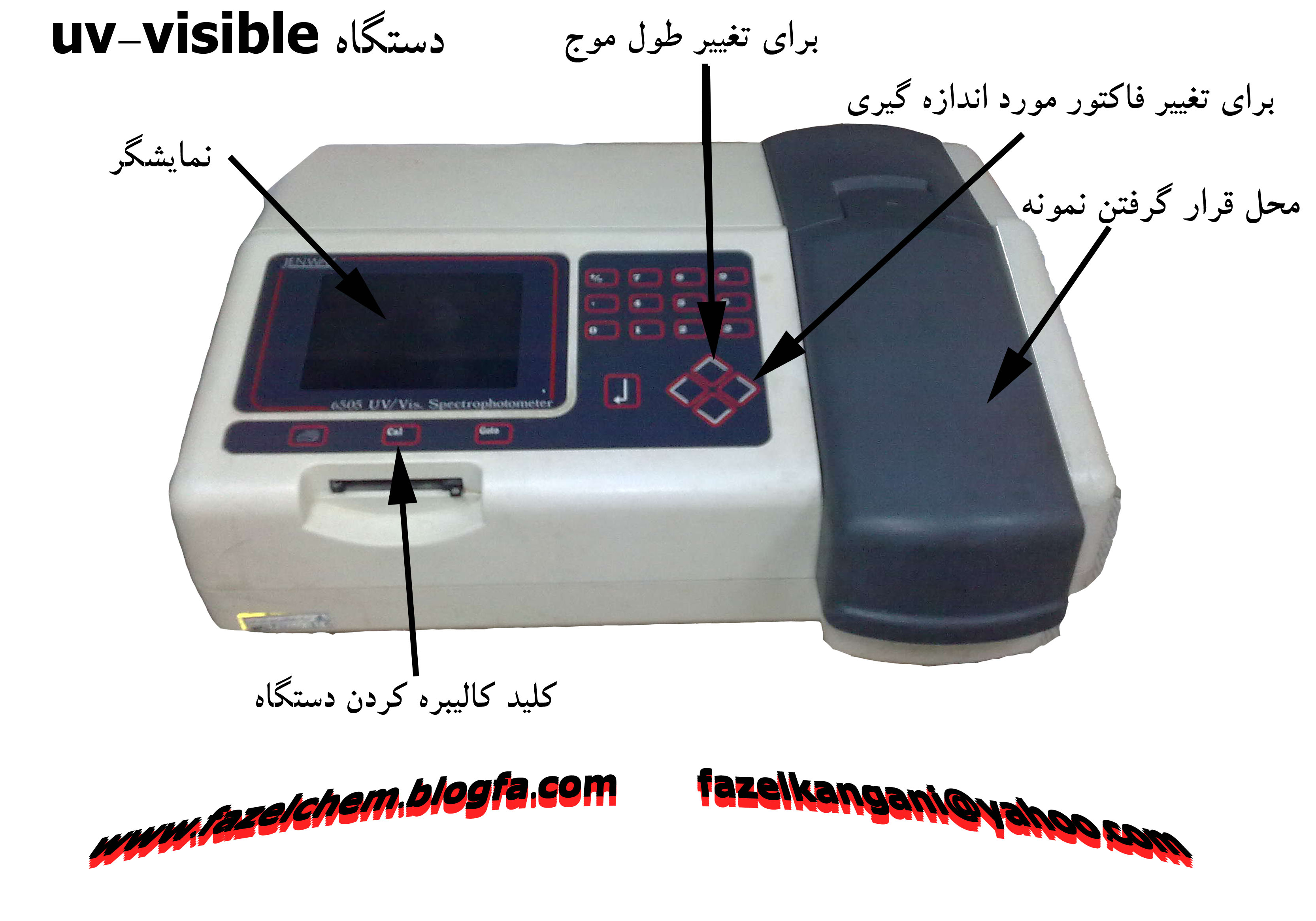
3 | ابزار شناسی |
4 | بیان چند نمونه از روش های صحیح کارکردن با وسایل آزمایشگاهی |
5 | بیان نحوه ی نوشتن گزارشکار |
6 | انجام آزمایش های شیمی (2) و شیمی (3)، توسط شرکت کنندگان |
7 | طراحی و انجام تعدادی از آزمایش های ابتکاری، توسط شرکت کنندگان |
8 | برطرف ساختن نقاط ضعف ، قوت و پاسخ به سئوالات شرکت کنندگان |
9 | برگزاری مسابقات آزمایشگاهی در سطح منطقه |
10 | تمرین و کار بیشتر با شرکت کننده ی برگزیده شده جهت آمادگی در مسابقات استانی |
الف) بیان نکات ایمنی در آزمایشگاه:
1- همیشه به خاطر بسپارید که آزمایشگاه، مکانی برای کارهای جدی و مسئولانه است.
2- همواره خود را برای درس آزمایشگاه آماده کنید. شرح آزمایش و دستور کارها را آگاهانه رعایت کنید و همه احتیاط های گفته شده را در نظر بگیرید.
3- تنها آزمایشی را که به شما گفته شده و در دستور کار هست، انجام دهید و هرگز آزمایش غیر مجاز انجام ندهید.
4- هرگاه اسید، باز یا هر ماده شیمیایی خورنده ای ریخته شود به فوری آن را با آب بشویید.
5- هرگز مواد شیمیایی را لمس نکنید، مگر آن که به شما گفته شود.
6- هرگز ماده شیمیایی یا محلول را در آزمایشگاه نچشید.
7- وقت کافی برای سردشدن وسیله های شیشه ای و داغ در نظر بگیرید. آن گاه به آن ها دست بزنید.
8- هر گونه آتش را فوری با یک حوله خاموش کنید. همواره محل دستگاه اتش نشانی و چگونگی کاربرد آن را به خاطر بسپارید.
9- هر گونه رویداد غیر عادی و یا کوچک ترین آسیب رسیده را فوری به معلم خود گزارش دهید.
10- هنگام کار با مواد و ابزار خطرناک، همواره از عینک محافظ استفاده کنید. در صورت لزوم و بر حسب دستورهای داده شده،
از هود ( محل آزمایش گازهای سمی که دارای هواکش است) استفاده کنید.
11- در آزمایشگاه همواره روپوش آزمایشگاه به تن کنید.
12- هر گونه کاغذ باطله، مواد جامد و دور ریختنی را در ظرف ویژه بریزید. هرگز چوب کبریت، کاغذ صافی و هر ماده کم محلول را در دست شویی میز آزمایشگاهی نیندازید.
13- بر چسب روی شیشه را پیش از برداشتن مقداری ماده، به دقت بخوانید، برای اطمینان بیش تر بر چسب را دو بار بخوانید.
14- هرگز ماده شیمیایی را که به کار نرفته است، به شیشه اصلی برنگردانید. هیچ گونه جسمی را در شیشه محتوی مایع شیمیایی وارد نکنید. تنها از قطره چکان یا لوله ویژه ی آن استفاده کنید.
15- میز کار و ابزار خود را بسیار تمیز نگه دارید. توجه داشته باشید که چیزی به اطراف نریزید و اگر ریخت فوری آن را تمیز کنید. وسیله را پس از تمیز کردن به سر جای خود برگردانید.
ب) آشنایی با علامت های هشدار دهنده:
ج) آشنایی با برخی از وسیله های آزمایشگاهی:
آبفشان پلاستیکی( پیست): وسیله ی که برای نگه داری آب مقطر یا
محلول و مایع های دیگر و ریختن مقدار های کم آن ها و شست شوی
لوله آزمایش و . . . کار برد دارد.
ارلن (ارلن مایر): برای گرم کردن محلول ها و مایع ها و یا برای نگهداری
آنها و همچنین در سنجش های حجمی به کار می رود.
ارلن تخلیه: برای ایجاد خلا در آزمایشگاه به منظور سرعت بخشیدن به عمل
صاف کردن و نیز برای تهیه مواد گازی شکل کاربرد دارد.
استوانه مدرج: برای برداشتن حجم معین و یا تعیین مایع ها و محلول ها و
نیز در تعیین حجم مواد جامد و یا چگالی آن ها کاربرد دارد.
بالون با لوله جانبی: وسیله ای ویژه تقطیر است و می توان به جای
ارلن تخلیه از آن بهره گرفت و از ارلن تخلیه شکننده تر است.
بالون ته گرد: وسیله ی برای گرم کردن محلول ها، یا مایع ها به ویژه در
عمل تقطیر است.
بالون پیمانه ای (بالون حجمی): کاربرد ویژه ی آن در تهیه محلول ها
( با غلظت معین) است.
بشر: برای گرم کردن محلول ها و مایع ها ، در سنجش های حجمی به کار
می رود. از نوع مدرج آن می توان برای برداشتن حجم معین و یا تعیین
حجم محلول ها و یا مایع ها استفاده کرد.
بوته چینی: وسیله ای از چینی که برای گرما دهی شدید و تجزیه کردن
مواد جامد در دمای کوره برقی و دمای چراغ گاز در آزمایشگاه کار برد دارد.
بورت مدرج: کاربرد ویژه آن در سنجش های حجمی است، معمولا
محلولی را که غلظت آن مشخص است در آن می ریزند.
میله و پایه فلزی: برای نگاه داشتن وسایلی مانند بورت، بالون و به طور
کلی سوار کردن دستگاه های مختلف( به کمک گیره ها) به کار می رود.
میله و پایه با گیره های حلقه ای: برای نگاه داشتن قیف در عمل
صاف کردن به کار می رود.
پنس بوته: نوعی پنس فلزی است که برای گذاشتن و برداشتن بوته چینی
روی چراغ گاز و یا در داخل کوره الکتریکی از آن استفاده می شود.
پیپت مدرج: برای برداشتن و یا ریختن مقدارهای معین دلخواه از مایع ها
یا محلول ها ( در مقیاس کم) به ویژه در سنجش حجمی کاربرد دارد.
پیپت حبابدار: برای برداشتن یا ریختن مقدار مشخص از مایع ها و یا
محلول ها به ویژه در سنجش های حجمی به کار می رود.
توری نسوز: نوعی توری فلزی است که در قسمت وسط آن پوششی
از ماده نسوز قرار داده شده و برای جلوگیری از تاثیر مستقیم شعله بر
آن چه که باید به وسیله گرم شود، به کار می رود.
جای لوله آزمایش: وسیله ای چوبی یا فلزی یا پلاستیکی که برای
قرار دادن و نگهداری لوله های آزمایش کاربرد دارد.
دستگاه خشک کننده( دسیکاتور): وسیله ای شیشه ای که در
قسمت پایین آن ماده نم گیری مانند اسید سولفوریک غلیظ می ریزند
و در بالای آن روی یک صفحه مشبک چینی، ماده خشک شدنی،
مایع یا جامد را قرار می دهند.
سه پایه فلزی: وسیله ای است فلزی که برای نگاهداشتن وسایل و
گرم کردن آنها در بالای شعله چراغ گاز آزمایشگاه کاربرد دارد.
مثلث نسوز: وسیله ای است فلزی که روکشی چینی از نسوز دارد و
معمولا آن را روی سه پایه قرار می دهند و برای نگهداری
بوته آزمایشگاهی و مشابه آنها بر روی سه پایه به کار می رود.
شیشه ساعت: وسیله ای شیشه ای که معمولا برای تبخیر محلول ها
به منظور ایجاد بلور در گرمای ملایم( مثلا بالای بخار آب) به کار می رود.
قطره چکان: برای برداشتن و یا ریختن مایع های سمی کاربرد دارد.
از نوع مدرج آن به جای پیپ مدرج، برای برداشتن حجم معینی از
مایع ها یا محلول های سمی استفاده می شود.
قیف ساده: برای صاف کردن و نیز انتقال مایع ها از ظرفی به ظرف
دیگر کاربرد دارد.
قیف جداکننده( دکانتور): برای جداکردن دو مایع که با یکدیگر
آمیخته نشده باشند، به کار می رود. ( مانند آب و روغن )
کپسول چینی: ظرفی از جنس چینی است که برای گرم و خشک
کردن مواد و یا گرفتن آب تبلور مواد بلوری به کار می رود.
گیره بالون: گیره فلزی است که برای نگهداشتن بالون، ارلن و. . .
به کمک شاخک و پایه کاربرد دارد.
گیره چوبی: برای نگهداشتن لوله آزمایش به کار می رود.
عینک پلاستیک: عینک محافظ برای محافظت چشم از پاشیدن
اسیدها، بازها و سایر مایع های خطرناک به آن ، همچنین
جلوگیری از پرتاب شدن اشیای فلزی یا تکه های شیشه به آن
به کار می رود.
هاون چینی: وسیله ای است که برای خرد و نرم کردن
مواد جامد در آزمایشگاه به کار می رود.
برس لوله( لوله شوی): برای شستن و تمیز کردن جدار
داخلی لوله آزمایش و مشابه آن کاربرد دارد.
شاخک گیره: وسیله ای فلزی که به کمک دو پیچ،
می توان گیره بالون را به پایه وصل کرد.
لوله آزمایش: لوله ای از شیشه معمولی و یا پیرکس که
یک طرف آن بسته است و در اندازه های گوناگونی موجود است.
چراغ بونزن : چراغ آزمایشگاه، یک وسیله فلزی گاز سوزی
است که برای ایجاد شعله و حرارت دادن به کار می رود.
قاشق ( اسپاتول): وسیله ای است که به صورت فلزی و چینی
وجود دارد، و برای نرم کردن پودر و برداشتن آن کاربرد دارد.
د) بیان چند نمونه از روش های صحیح کارکردن با وسایل آزمایشگاهی:
1) روش کار کردن با ترازوی آزمایشگاهی 2) روش به حجم رساندن بالون حجمی 3) روش وارد کردن لوله در چوب پنبه
4) روش خشک کردن لوله ی آزمایش 5) روش کار کردن با پیپت پرکن 6) نحوه ی نگاه داشتن لوله آزمایش در هنگام کار
7) نحوه ی تنظیم چراغ گاز 8) نحوه ی استفاده از شعله گاز 9) روش تهیه ی کاغذ صافی برای قیف آزمایشگاهی
10) روش برداشتن مواد جامد از ظرف مربوطه 11) شیوه ی ریختن محلول در ظرف استوانه 12) شیوه ی رقیق کردن اسید
13) شیوه ی درست خواندن حجم مایع ها از روی استوانه ی مدرج، پیپت مدرج، بورت و ... 14) روش درست به هم زدن محلول ها
15) شیوه ی درست بوییدن بخار مواد شیمیایی در آزمایشگاه 16) شیوه ی باز کردن در شیشه ی ماده ی شیمیایی
17) روش جمع آوری گاز تولید شده را در آزمایشگاه
و) بیان نحوه ی نوشتن گزارشکار:
برای نوشتن گزارشکار باید، موارد زیر را در گزارشکار بنویسیم.
1) بنام خدا 2) نام و نام خانوادگی فرد آزمایش کننده 3) عنوان آزمایش 4) مواد و وسایل مورد نیاز در آزمایش مورد نظر
5) شرح آزمایش یا روش کار 6) نتیجه گیری یا پاسخ به پرسش ها
ت) انجام آزمایش های شیمی (2) و شیمی (3)، توسط شرکت کنندگان:
در این مرحله، شرکت کنندگان باید به صورت گروه های 2یا 3 نفره، در بیایند و آنگاه هر گروه، زیر نظر مربی یا معلم خود،
آزمایش های موجود در کتاب های شیمی(2) و شیمی(3) را بصورت جداگانه انجام بدهند و سپس گزارشکار، آزمایش ها را بنویسند.
پ) طراحی و انجام تعدادی از آزمایش های ابتکاری، توسط شرکت کنندگان
1) در این مرحله، شرکت کنندگان ، باید بتوانند که آزمایشی در رابطه با موضوح خواسته شده، طراحی کرده و سپس با رعایت کلیه
اصول ایمنی آن را به درستی ،انجام دهند.
2) ویا اینکه بتوانند به خوبی آزمایش های ابتکاری داده شده را با استفاده از معلومات و مهارت های خود انجام داده و به سئوالات
مطرح شده درپایان آزمایش، پاسخ دهند.
که دراینجا، چند نمونه از آزمایش ها ی نوع (1) را می آوریم، که شرکت کنندگان بعد از انجام آن ها، باید گزارشکار، آزمایش
مربوطه را بنویسند.
آزمایش اول: آزمایشی را طراحی و سپس اجرا کنید که، کشش سطحی آب را اثبات نماید.
آزمایش دوم: آزمایشی را طراحی و سپس اجرا کنید که، نشان دهد، مولکول آب قطبی است.
آزمایش سوم: آزمایشی را طراحی و سپس اجرا کنید که، ثابت کند، محلول آب نمک رسانای جریان برق است.
آزمایش چهارم: آزمایشی را طراحی و سپس اجرا کنید که، نشان دهد، فشار هوا قویتر از نیروی جاذبه ی زمین است.
آزمایش پنجم : آزمایشی را طراحی و سپس اجرا کنید که، فشار یکطرفه ی هوا را از بیرون به درون جسم را نشان دهد.
آزمایش ششم: آزمایشی را طراحی و سپس اجرا کنید که، فشار یکطرفه ی هوا را از درون به بیرون جسم را نشان دهد.
آزمایش هفتم: آزمایشی را طراحی و سپس اجرا کنید که، نشان دهد، چگالی هوای داغ کمتر از چگالی هواکره است.
آزمایش هشتم: آزمایشی را طراحی و سپس اجرا کنید که، انواع اکسایش( سوختن- اکسید شدن) را نشان دهد.
آزمایش نهم: آزمایشی را طراحی و سپس اجرا کنید که آلاینده ی نوع دوم هواکره را نشان دهد.
آزمایش دهم: آزمایشی را طراحی و سپس اجرا کنید که، ثابت نماید، گرانروی مایعات با هم تفاوت دارد.
آزمایش یازدهم: آزمایشی را طراحی و سپس اجرا کنید که، نشان دهد، واکنش پذیری فلزات با هم دیگر تفاوت دارد.
آزمایش دوازدهم: آزمایشی را طراحی و سپس اجرا کنید که، بتوان چگالی ، یک گلوله فلزی و یک تکه چوب را مشخص کرد.
آزمایش سیزدهم: آزمایش های را طراحی و سپس اجرا کنید که بتوان گا زهای کربن دی اکسید( CO2) ، نیتروژن ( N2 ) ،
هیدروژن ( H2)، گوگرد دی اکسید( SO2 ) و اکسیژن ( O2 ) را شناسایی کرد.
آزمایش چهاردهم: آزمایش های را طراحی و سپس اجرا کنید که، نشان دهد، هوا را اکسیژن تشکیل می دهد.
آزمایش پانزدهم: آزمایش های را طراحی و سپس اجرا کنید که، نشان دهد، حجم گاز کربن دی اکسید حل شده در نوشابه تقریبا 4 برابر
حجم مایع آن می باشد.
آزمایش شانزدهم: آزمایشی را طراحی و سپس اجرا کنید که، نشان دهد، محلول اکسید فلزات درآب، خاصیت اسیدی دارد.
آزمایش هفدهم: آزمایشی را طراحی و سپس اجرا کنید که، نشان دهد، محلول اکسید نافلزات درآب، خاصیت بازی دارد.
آزمایش هیجدهم: آزمایشی را طراحی و سپس اجرا کنید که، سوختن منیزیم را در کربن دی اکسید را نشان دهد.
آزمایش نوزدهم: آزمایشی را طراحی و سپس اجرا کنید که، واکنش مس(II) سولفات را با آلومینیم، نشان دهد.
آزمایش بیستم: آزمایش های را طراحی و سپس اجرا کنید که، بتوان گازهای متان( CH4 )، اتیلن(C2H4 ) و استیلن ( C2H2 ) را
تولید کرد.
که دراینجا، چند نمونه ازآزمایش ها ی نوع (2) را می آوریم، که شرکت کنندگان باید با استفاده از معلومات و مهارت های خود انجام داده
و سپس به سئوالات مطرح شده درپایان آزمایش پاسخ دهند.
آزمایش بیست و یکم: طراحی و اجرای آزمایش( آب سخت)
آزمایش بیست و دوم: واکنش شیمیایی
در داخل ظرف A محلول مس(II) سولفات رقیق موجود است. در یک جا لوله ای سه لوله آژمایش از 1تا 3 شماره گذاری کنید.
در لوله شماره 1و2 تا ارتفاع 4 سانتیمتر محلول ظرف A را بریزید و سپس 3 عدد میخ آهنی تمیز در لوله شماره 1 قرار دهید.
3 دقیقه صبر کنید تا واکنش انجام گیرد. فقط محلول شماره 1 را به لوله شماره 3 منتقل کنید. در این مرحله به هر دو لوله شماره 2و3
چند قطره محلول سود ( NaOH ) 2 مولار اضافه کنید و به پرسش های زیر پاسخ دهید:
الف) در لوله ی شماره 1 واکنش از چه نوعی صورت می گیرد؟ معادله واکنش را بنویسید.
ب) در موارد زیر چه رنگی مشاهده کرده اید؟
الف) رسوب روی میخ ها ب) تغییر رنگ محلول شماره 1
ج) رسوب حاصله در لوله شماره 2 د) رسوب حاصله در لوله شماره 3
ج) معادله واکنش های انجام شده در لوله 2و3 را نوشته و موازنه کنید.
پرسش ها:
1) به نظر شما اگر میخ ها زنگ زدگی داشته باشند چه اشکالی پیش می آید؟
2) به فرض اینکه 1/0 مول آهن با مخلوط مس(II) سولفات واکنش دهد و رسوب حاصله از سطح میخ ها جدا نشود، جرم میخ ها چه
تغییری می کند؟ ( زیاد می شود یا کم می شود؟ ) چرا؟ (( Fe = 56 , Cu = 63/50 g/mol
آزمایش بیست و سوم: ( تعیین درصد کلسیم کربنات در یک نمونه ناخالص به وسیله HCl )
2گرم نمونه را وزن کنید و آن را با 20mL محلول 4HCl مولار واکنش دهید.
الف) معادله واکنش را نوشته و موازنه کنید.
ب) با توجه به نتایج حاصله، درصد کلسیم کربنات(CaCO3) را در نمونه تعیین کنید.
پرسش ها:
1) چرا هم زدن، فرایند واکنش را تسهیل می کند؟
2) اگر HCl محدود کننده باشد، چه اشکالی پیش می آید؟
3) به نظر شما چه خطاهایی ( خطای غیر دستگاهی ) بازده واکنش را کم می کنند؟
4) چه روش دیگری را برای تعیین درصد خلوص نمونه فوق پیشنهاد می کنید؟
آزمایش بیست و چهارم: ساختن محلول 1 مولار از یک محلول سیرشده
از محلول سیرشده نمک طعام که در اختیار شما قرار داده است. 100mL محلول 1mol/L بسازید.
اطلاعات مورد نیاز:
انحلال پذیری نمک طعام در دمای آزمایشگاه برابر 36 گرم در 100 گرم آب است.
جرم مولی Na برابر 23g/mol و جرم مولی Cl برابر 35/50g/mol است.
الف) محاسبات انجام شده را در این قسمت بنویسید.
ب) مراحل ساختن محلول را به طور مختصر( در دو سطر) توضیح دهید.
پرسش ها:
1) چگونه می توان متوجه شد که آیا محلول اولیه سیرشده است یا خیر؟
2) چرا سطح آب درون ظرف به صورت مقعر می باشد؟
3) رسانایی الکتریکی محلول سیرشده NaCl بیشتر است یا رسانایی الکتریکی محلول 1 مولار آن ؟ چرا؟
4) نحوه ساختن محلول 1 مولال NaCl را از نمک جامد آن به طور مختصر بنویسید.
آزمایش بیست و پنجم: ( شناسایی مواد مجهول)
در ظرف های A وB و C و D ، چهار نوع پودر سفید رنگ وجود دارد که ممکن است یکی از مواد CaO وP4O10 و Na2O2
و NaCl باشند، با طراحی آزمایش های مناسب این مواد را از هم تشخیص دهید.
پرسش ها:
1) یک قاعده ی کلی در مورد خواص اکسیدهای فلزی و نافلزی بیان کنید.
2) انحلال پذیری ترکیبات یونی در آب به چه عواملی بستگی دارد؟
3) آیا می توان برای تشخیص P4O10 از شناساگر فنل فتالئین استفاده کرد؟ چرا؟
4) اگر نمک های CaCl2 و NaCl و KCl و CuCl2 را در شعله بسوزانیم، انتظار داریدشعله چگونه تغییر رنگ دهد؟
5) توضیح دهید که چگونه مجهول های نامبرده را از هم تشخیص داده اید؟
آزمایش بیست و ششم: ( تعیین غلظت محلول سدیم هیدروکسید)
با استفاده از وسایل و مواد موجود بر روی میز کار، 100 میلی لیتر محلول هیدروکلریک اسید( HCl ) با غلظت 1/0 مولار از اسید
اولیه ی 2M تهیه نمایید.
( توجه: مراقب باشید اسید بر روی پوست دست یا لباس شما نریزد.)
سپس 10میلی لیتر از اسید تهیه شده را در یک ارلن ریخته، 2-1 قطره فنل فتالئین به آن اضافه کنید.
از نمونه محلول سدیم هیدروکسیدی که در اختیار شماست، با استفاده از پیپت مدرج، قطره قطره به محلول درون ارلن اضافه کنید تا رنگ
محلول ارغوانی شود( با افزایش هر قطره محلول سدیم هیدروکسید محلول درون ارلن را تکان دهید)
پرسش ها:
1- چه حجمی از محلول سدیم هیدروکسید مصرف نموده اید.
2- معدله ی واکنش انجام یافته را بنویسید.
3-چرا ارغوانی شدن محلول نشانه ی پایان کار است؟
4- با استفاده از روابط استوکیومتری، غلظت محلول سود را به دست آورید.
5- در مقدار سود مصرف شده، چند گرم سدیم هیدروکسید وجود دارد؟ ( جرم مولی ( NaOH = 40g
آزمایش بیست و هفتم: ( به دست آوردن ید به صورت I2 )
مواد روی میز: محلول های KI ، KBr ، KCl ، HCl و KBrO3 که غلظت همه یک مولار (1M ) هستند( بعضی مواد اضافی است.)
الف) با مواد فوق روشی را طراحی کنید که بتوانید ید را در محلول آبی به صورت I2 تولید کنید. ( روش خود را در دو سطر توضیح دهید)
ب) معادله واکنش های روش خود را بنویسید و موازنه کنید.
ج) چه مایعی را برای استخراج ید از آب پیشنهاد می کنید؟ چرا؟
آزمایش بیست و هشتم: ( تعیین ∆H انحلال نمک A )
هدف: تعیین ∆H انحلال نمک A با جرم مولی 111g.mol-1 به کمک کالریمتر لیوانی و ابزار و وسایل و مواد موجود روی میز
آزمایشگاه با فرض اینکه 4/2 j/gC = محلول C و ظرفیت گرمایی کالریمتر برابر است با 100 ژول بر درجه سانتی گراد.
1) شرح مختصر آزمایش ( حداکثر در چهار سطر )
2) عملیات و محاسبات:
3) به اختصار به سئوالات زیر پاسخ دهید.
1) ∆H انحلال را تعریف کنید.
2) چه مواردی در این آزمایش ایجاد خطا می کند.( ذکر دو مورد کافی است)
3) انحلال فوق گرماگیر یا گرماده است؟
4) ∆H انحلال به مسیر انتخابی برای انجام آزمایش بستگی دارد یا خیر؟ چرا؟
آزمایش بیست و نهم: شناسایی انواع مخلوط ( محلول – کلویید – سوسپانسیون )
مقداری آهن (III) کلرید را در یک بشر دارای 200میلی لیتر آب است، بریزید تا که در آن حل شود.
1) در بشر اول حدود 50 میلی لیتر از محلول آهن (III ) کلرید بریزید.
2) در بشر دوم نیز 50 میلی لیتر از محلول آهن (III ) کلرید بریزید. و سپس بر روی آن در حدود 50میلی لیتر از محلول،
سدیم هیدروکسید 1/0 مولار اضافه کنید تا مخلوط ناهمگن جامد در مایع ( سوسپانسیون) طبق واکنش زیر به دست آید.
FeCl3 + 3NaOH Fe(OH)3 + 3NaCl
3) در بشر سوم نیز 50 میلی لیتر از محلول آهن (III ) کلرید بریزید. و بر روی آن 50 میلی لیتر آب جوش اضافه کنید تا مخلوط
کلوییدی طبق واکنش زیر به دست آورید. FeCl3 + 3H2O Fe(OH)3 + 3HCl
پرسش ها:
1- در یک جای تاریک با کمک یک چراغ قوه به هر 3 بشر پرتوهایی را بتابانید. چه چیزی را در مورد هر یک مشاهده می کنید؟
2)محلول چه تفاوتی با کلویید دارد؟
3) کلویید چه تفاوتی با سوسپانسیون دارد؟
آزمایش سی ام: انحلال پذیری
نمونه ای از یک نمک مجهول در اختیار شما قرار داده شده است. 20 گرم آب با دمای آزمایشگاه و 60درجه ی سانتی گراد را برداشته
و از نمک مجهول آنقدر در آب حل کنید تا محلول به حالت سیرشده در آید. ( توجه: وسایل لازم بر روی میز کارشما قرار داده شده است.)
پس از انجام آزمایش، به پرسش های زیر پاسخ دهید:
1- جدول زیر را کامل کنید.
دما ( درجه سانتی گراد) | دمای آزمایشگاه | 60 C |
گرم نمک حل شده | | |
2- نمودار انحلال پذیری این نمک را رسم نمایید.
3- با توجه به نمودار انحلال پذیری داده شده،
مشخص کنید نمک مجهول، کدام نمک در نمودار است؟
بسمه تعالی
اداره آموزش و پرورش شا ل
می شنوم و فراموش می کنم
می بینم و به خاطر می آورم
انجام می دهم و می آموزم
موضوح: مجموعه ای از فعالیت های قابل اجراء در دوره ی آمادگی مسابقات آزمایشگاهی
تهیه و تنظیم: مظاهر کریمی
استان / منطقه : قزوین – شال
سال تهیه: سال الگوی مصرف ( 22/ 11 / 88 )
آزمایش سی و یکم: تعیین درصد وزنی ( درصد خلوص)
تعیین درصد وزنی KClO3 در مخلوط KClO3 و KCl
روش کار: برای تعیین درصد وزنی KClO3 در نمونه، 1g از نمونه را در لوله آزمایش کاملا خشک ریخته،
با مقدار کمی کاتالیزگرMnO2 مخلوط نموده و حرارت دهید. در مواقع لازم وزن مواد را یادداشت کنید.
پرسش ها:
1- دو روش برای خشک کردن لوله آزمایش بیان کنید.
2- واکنش مربوطه را بنویسید. و موازنه کنید.
3- چگونه می توان پی برد که واکنش پایان یافته است؟
4- وزن کاتالیزگر چه تغییری می کند؟ چرا؟
5- گاز خارج شده چیست و چگونه شناسایی می شود؟
6- با استفاده از تغییر وزن مواد در اثر واکنش، درصد وزنی KClO3 در مخلوط آن با KCl را حساب کنید.
( K = 39 , Cl = 35/5 , O = 16 )
7- حجم گاز آزاد شده چقدر است؟ ( حجم مولی گازها در شرایط آزمایشگاه را 25L.mol-1 فرض کنید.)
8- روش دیگری برای تشخیص درصد KClO3 در مخلوط فوق پیشنهاد کنید.
آزمایش سی و دوم: تهیه محلول با غلظت مشخص از مواد جامد و مایع و تعیین واکنش گر محدودکننده
روش کار:
1- 250mL محلول KOH 0/1M ( با درجه خلوص 90) تهیه کنید.
2- ظرف A محتوی سولفوریک اسید 0/2M است. با روش مناسب 100mL محلول 0/1M آن را تهیه کنید.
3- در یک ارلن 250میلی لیتری 100mL محلول KOH با غلظت 0/1mol.L-1 بریزید و چند قطره فنل فتالئین به آن اضافه کنید.
سپس 100mL محلول سولفوریک اسید 0/1mol.L-1 به آن اضافه کنید تا با محلول قبلی واکنش دهد.
در این صورت مشخص کنید که کدام ماده محدودکننده است و کدام اضافی و چند مول از واکنش دهنده اضافی باقی می ماند؟
پرسش ها:
1- معادله واکنش محلول KOH و محلول سولفوریک اسید را بنویسید.
2- واکنش فوق از کدام نوع واکنش است؟ چرا؟
3- چه عواملی در انجام آزمایش باعث خطا می شود و چگونه می توان خطا را کاهش داد؟ 2 عامل را نام ببرید.
4- سولفوریک اسید و KOHهر کدام چه کاربردهایی دارند؟ هر کدام یک کاربرد.
5- روش تشخیص ماده محدود کننده را توضیح دهید.
6- روش محاسبه جرم دقیق KOH با توجه به درجه خلوص آن را بیان کنید.
7- مراحل محلول سازی در آزمایش های 1و2 را به طور کامل توضیح دهید.
آزمایش سی و سوم: تقطیر جزء به جزء نفت خام
ابزار و مواد نیاز: 30mL نفت خام( می توان به جای آن از مخلوط بنزین، پارافین، نفت سفید و روغن موتور استفاده کرد.)
4 عدد بشر50mL – کلیه اجزای دستگاه تقطیر جزء به جزء – سنگ جوش( یا پشم شیشه) – چراغ گاز – دما سنج 0C- 250C
4عدد شیشه ساعت
هشدار: چون ترکیب هایی که در این آزمایش استفاده می شوند، آتش می گیرند و مخلوط آنها با هوا منفجر شونده است. به نکات زیر توجه کنید:
1- کوشش شود در صورت امکان از شعله مستقیم برای گرما دادن به نفت خام استفاده نشود.
2- حداقل مقدار نفت خام، برای آزمایش به کار رود.
3- اطمینان حاصل شود که همه اتصال های دستگاه تقطیر نشت بخار نداشته باشند.
4- توصیه می شود که از عینک محافظ ، دستکش و همچنین صفحه محافظ استفاده شود.
5- کپسول آتش نشانی متناسب در اختیار باشد.
روش کار:
الف- 30mL نفت خام را با یک یا دو دانه سنگ چوش در یک بالون 100mL قرار دهید و سپس طبق شکل زیر دستگاه را سوار کنید.
و پس از مرور نکات ایمنی و اطمینان از رعایت آنها، شیر آب سرد را باز کرده و گرما دادن را شروع کنید. انگاه دمایی که در آن
نخستین جزء شروع به خروج از انتهای خنک کننده می کند را یادداشت کنید.
ب- هنگامی که دماسنج به سرعت افزایش دما را نشان داد ظرف ماده جمع آوری شده را عوض کنید و به جای آن بشر خالی دیگری
بگذارید. سپس دمای جدید دماسنج را یادداشت کنید. این عمل را تا به دست آوردن نمونه های دیگر تکرار نمایید. توجه نمایید که دمای
دماسنج بالاتر از 250C نرود.
ج- بالون تقطیر را که محتوی ماده ی سیاه رنگی است از دستگاه جدا کنید و ماده ی درون آن را به کمک یک میله شیشه ای به روی یک
شیشه ساعت بزرگ منتقل کنید تا سرد شود. و ویژگی های زیر را برای هر یک از اجزای تقطیر شده و باقیمانده با هم مقایسه کنید.
1- دمای تقطیر 2- رنگ ماده تقطیر شده 3- رفتار جزء تقطیر شده هنگامی که سه قطره از آن روی شیشه ساعتی قرار داده و کبریت
برافروخته به آن نزدیک می شود.
پرسش ها:
1- چه ویژگی سبب شده است که نخستین جزء تقطیر زودتر از اجزای دیگر تقطیر شود؟
2- آیا هر جزء تقطیر شده در آزمایش فوق یک ماده خالص است؟ علت آن را توضیح دهید.
3- چرا اولین جزء تقطیر شده، زودتر آتش می گیرد؟
4- آیا می توانید اجزایی را که به دست آورید با یکی از فرآورده های شناخته شده نفتی منطبق نمایید؟
آزمایش سی و چهارم: طراحی و اجرای آزمایش ( شناسایی ماده )
چهار ماده ی مجهول D , C , B , A موجود است هر یک از مواد NaI , Pb(NO3)2 , NaCl , NaHCO3 , NaBr باشد
( یکی از آن ها جزو مواد مجهول نیست) با توجه به شناساگرهایی که بر روی میز کار آزمایشگاه وجود دارد هر یک را شناسایی نموده،
و در گزارش کار خود، بطور کامل آن ها را بنویسید.
شناساگرها: KI – HCl – مایع سفید کننده – تولوئن )
توجه:
1- هنگام استفاده از تولوئن این ماده را قبل از افزودن HCl در لوله ی آزمایش بریزید و مراحل بعد را انجام دهید.
2- هنگام استفاده از مایع سفید کننده و تولوئن درب لوله ی آزمایش را ببندید.
3- شناساگرها را به مقدار کم استفاده نمایید.
آزمایش سی و پنجم: شناسایی ترکیبات شیمیایی
بر روی میز کار شما چهار ترکیب شیمیایی با نامهای A و B و C و D بصورت محلول در چهار لوله آزمایش مجزا قرار دارند،
که این ترکیبات عبارتند از : ، ، ،
برای اجرای این آزمایش دستورالعمل زیر را انجام دهید:
1. برای شناسایی این مواد فقط از محلولهای A و B و C و D استفاده کنید.
2. محتویات هر لوله را بنابر صلاحدید خود به چند قسمت به عنوان نمونه تقسیم کنید.
3. نتایج افزایش هر محلول را برروی دیگری ثبت کرده و آن ها را تحلیل نمائید.
4. پس از شناسایی با توجه به برچسب هر لوله، نام هر محلول را در گزارش کار خود ثبت کنید.
محلول A | محلولB | محلولC | محلولD |
| | | |
5. معادلات انجام شده برای شناسایی هر محلول را بنویسید.
6. تحلیل های خود را به اختصار شرح دهید.
آزمایش سی و ششم: آزمون طراحی
- شکل زیر انحلال HCl در آب و تولوئن را نشان میدهد. با توجه به آن به سئوالات پاسخ دهید .
پرسش ها:
1- معادله واکنش انجام یافته در مرحله 1 را بنویسید ؟
2- چرا در تهیه ( g) HCl از نمک جامد و H2SO4 غلیظ استفاده میشود ؟
3- با جابجا شدن مراحل 3 و 4 آیا تغییری در نتیجه آزمایش حاصل میشود؟ چرا ؟
4- درجه دماسنج در مرحله 4 چه تغییری میکند ؟چرا ؟
5- با افزودن چند قطره معرف تورنسل در ظروف مرحله های 3 و 4 چه تغییر رنگی را پیش بینی میکنید ؟ علت را توضیح دهید ؟
6- اگر به مقداری از محلول های دو ظرف مراحل 3 و 4 تکه کوچکی از CaCO3 ( کلسیم کربنات ) اضافه کنیم ،
چه پدیده ای رخ میدهد ؟ علت را بیان کنید ؟
7 - میزان روشنایی لامپ را در دو ظرف مراحل 3 و 4 با ذکر علت مقایسه کنید.
آزمایش سی و هفتم: آنیون یا کاتیون شناسی
نمک مجهول شما یکی از کاتیونهای Mg - Zn - Pb - Ca و یا یکی از آنیونهای Br SO4 – CO3 - - Clاست .
یک نمک مجهول را به دلخواه انتخاب کنید : M گرم از آن را بردارید ، کاتیون یا آنیون نمک مجهول خود را شناسایی کنید .
پرسش ها:
1- از کدام معرّف برای شناسایی آنیون Cl و Br استفاده می شود؟
2-با توجه به پاسخ سؤال اول چگونه می توان رسوب حاصل از اضافه کردن معّرف به محلولهای Cl و Br را از یکدیگر تشخیص داد؟
3- چگونه می توان رسوب PbCl را از رسوب PbBr تشخیص داد ؟
4- پس از پایان کار خود ، نوع آنیون یا کاتیون مجهول انتخاب شده را بنویسید .
آزمایش سی و هشتم: طرز تهیه برم
الف- با انجام یک آزمایش برم تهیه کنید، و همچنین طرز شناسایی برم حاصل ، از ید را بنویسید.
ب) با انجام آزمایش فعالیت شیمیایی سدیم و پتاسیم را با هم مقایسه کنید .
پرسش ها:
1-چرا در اثر انداختن فلز سدیم در آب ، شعله ایجاد نمی شود ولی در اثر انداختن فلز پتاسیم در آب ، شعله ایجاد می شود ؟
2- 1 گرم سدیم و 1 گرم پتاسیم را در 50 میلی لیتر آب می اندازیم . کدامیک گاز بیشتری آزاد می کند ؟ چرا؟
3- با توجه به سؤال 2 غلظت مولار کدام محلول تولید شده ، بیشتر است چرا؟
4- طرز تهیه آلومینیوم هیدروکسید چگونه است ؟
آزمایش سی و نهم: واکنش جابجایی یگانه
الف- آزمایشی انجام دهید که واکنش بین فلز Al با محلول مس ` سولفات را نشان دهد .
ب- آزمایشی انجام دهید که واکنش بین فلز Cu با محلول نقره نیترات را نشان دهد .
پرسش ها:
1- با توجه به آزمایشهای انجام شده ، در کدام مورد در اثر انجام واکنش ، گاز آزاد می شود و در کدام مورد گازی حاصل نمی شود .
در هر مورد با ذکر علت توضیح دهید ؟
2- در اثر واکنش بین فلز Al با محلول مس ` سولفات ، اندازه کدام گونه کاهش و اندازه کدام گونه افزایش می یابد چرا ؟
3- چرا محلول نقره نیترات را در ظرف تیره نگه داری می کنند ؟
4- پس از پایان واکنش ، جرم Al باقیمانده ، کاهش می یابد یا افزایش چرا؟
5- برای تهیه محلول مس ` سولفات مقداری از این نمک را داخل آب می ریزیم . برای تسریع حل شدن این نمک در آب یک روش بنویسید.
آزمایش چهلم:
الف- آزمایشی را طراحی کنید که توسط آن بتوان ظرفیت گرمایی ویژه ی آب و الکل (OH H C ) را با یکدیگر مقایسه کرد .
ب- آزمایشی را طراحی کنید که توسط آن بتوان مقدار گاز CO حل شده در یک نوشابه گازدار را معین کرد .
پرسش ها:
1-سه روش ذکر کنید که توسط آنها بتوان حداکثر گاز موجود در نوشابه را خارج کرد ؟
2- چرا حجم گاز جمع آوری شده ، از حجم واقعی گاز موجود در نوشابه ، کمتر است ؟ ( خطای آزمایش)
3- برای برطرف کردن خطای آزمایش چه راههایی را پیشنهاد می کنید .
آزمایش چهل یکم:
الف- آزمایشی انجام دهید که قانون شارل را اثبات نماید.
ب- آزمایشی انجام دهید که قانون بویل را اثبات نماید.
پرسش ها:
1- گرما چه تاثیری بر جحم گازها دارد؟
2- چرا با کاهش حجم یک نمونه گاز در دمای ثابت، فشار گاز افزایش می یابد؟
آزمایش چهل دوم:
الف- آزمایشی انجام دهید که بتوان نقطه ی جوش الکل را اندازه گیری کرد؟
ب- آزمایشی انجام دهید که افزایش نقطه ی چوش محلول ها را نشان دهد.
پرسش ها:
1- چرا نمی توان با کمک دماسنج الکلی، نقطه ی چوش آب را اندازه گیری کرد؟
2- چرا نقطه ی چوش محلول ها بالاتر از نقطه ی چوش حلال خالص است؟
آزمایش چهل سوم:
الف- آزمایشی انجام دهید که بتوان ظرفیت گرمایی، گرماسنج را تعیین کرد.
ب- آزمایشی انجام دهید که بتوان آنتالپی ذوب یخ را تعیین کرد.
پرسش ها:
1- چه رابطه ای بین ظرفیت گرمایی و ظرفیت گرمایی ویژه وجود دارد؟
2- پدیده ی ذوب یخ فرآیندی گرماگیر است یا گرماده؟ چرا؟
آزمایش چهل چهارم:
الف- آزمایشی را طراحی و سپس اجرا کنید که بتوان بازده درصدی واکنش را مشخص کرد.
ب- آزمایشی را طراحی و سپس اجرا کنید که از نوع ترکیب باشد.
ج- آزمایشی را طراحی و سپس اجرا کنید، که بازگردانی آهن یا مس را نمایش دهد.
د- آزمایشی را طراحی و سپس اجرا کنید، که اثر کاتالیزی مواد را نمایش دهد.
آژمایش: چهل و پنجم
تعیین آنتالپی واکنش(I)
روش کار:
حدود10گرم نمک باریم کلرید آبدار دراختیاردارید.
1) 5/2گرم ازنمک متبلوررا در 15گرم آب حل کرده، آنتالپی آن را بااستفاده ازکالریمتر تعیین کنید .سپس آنتالپی مولی انحلال آن را محاسبه نمائید.
2) 5/2گرم از نمک متبلور را حدود 15 دقیقه به شدت حرارت دهید تا ملکول های آب متبلور آن خارج گردد.وپس ازسردکردن آن با ابزارهای مناسب ،آنتالپی مولی انحلال نمک بدون آب را نیزبدست آورید
3) براساس قانون هس، آنتالپی واکنش (I) راچگونه می توان تعیین کرد. (ازواکنش های مربوط به آزمایش مرحله (1)و(2)استفاده کنید) .
4- آنتالپی واکنش رابدست آورید.
اطلاعات موردنیاز:
,
ظرفیت گرمایی کالریمتر= 60 (شصت ژول بر درجه سانتی گراد)
ظرفیت گرمایی ویژه محلول = 2/4 فرض شود. و چگالی آب =
(از جرم نمک صرف نظر گردد)
پرسش :
1-برای نمک باریم کلرید بدون آب یک کاربرد بیان کنید.(5/0 نمره)
2-فرآیند آب دارشدن نمک خشک فیزیکی است یاشیمیایی ؟چرا؟( 1)
3-ظرفیت گرمایی گرماسنج راچگونه تعیین می کنید؟(1)
آزمایش :چهل و ششم
موضوع آزمایش : تعیین در صد خلوص سدیم کلرید در یک نمونه سنگ معدن
روش کار:
از یک نمونه آزمایشی سنگ معدن سدیم کلرید پودر شده که دارای نا خالصی سدیم کربنات است 3 گرم در اختیار دارید.
1- ازهمه نمونه 100میلی لیتر محلول تهیه کنید.
2- 100میلی لیتر محلول هیدروکلریک اسید 1/0مولار از اسید 2 مولار تهیه کنید و با آن بورت را پر کنید.
3- 10 میلی لیتر از محلول تهیه شده مرحله اول را داخل ارلن بریزید و چند قطره شناساگر متیل نارنجی به آن اضافه نموده و از بورت به آرامی به آن اسید 1/0 مولار اضافه کنید و نقطه پایانی را توسط شناساگر متیل نارنجی مشخص نمائید.
(راهنمایی: نقطه پایانی نقطه ای است که هنگام خنثی شدن یا کامل شدن واکنش شناساگر تغییر رنگ می دهد.)
4- با استفاده از حجم اسید مصرفی و معادله موازنه شده و روابط استوکیومتری درصد خلوص سدیم کلرید را به دست آورید.
پرسش:
1- چرا در مدت سنجش بهتر است محلول داخل ارلن پیوسته بهم زده شود؟
2- چگونه می توان ناخالصی این نمک را به ترکیبات ید دار تبدبل کرد؟
3- برای تهیه هیدرو کلریک اسید در آزمایشگاه از سدیم کلرید، روشی مناسب پیشنهاد کنید. معادله یا معادله های لازم را بنویسید و شکل دستگاه پیشنهادی را رسم نمائید.
آزمایش :چهل و هفتم
تعیین گرمای واکنش خنثی شدن پتاسیم هیدروکسید با سولفوریک اسید
1- 100 میلی لیتر محلول 1 مولار پتاسیم هیدروکسید تهیه کنید .
2- محلول1 مولار سولفوریک اسید دراختیار شما قراردارد. با مقدار کافی ازآن، محلول پتاسیم هیدروکسید تهیه شده را خنثی نموده وگرمای آزاد شده را تعیین کنید.
( ظرفیت گرمایی گرماسنج را 100 وظرفیت گرمایی ویژه محلول را 5/3 وچگالی محلول را 1/1 درنظر بگیرید)
پرسش :
1- معادله واکنش انجام شده را نوشته و واکنش را محاسبه کنید.
2- چهار مورد از عوامل ایجاد کننده خطا در این آزمایش را بنویسید.
3 - مقادیر و این واکنش را با ذکردلیل مقایسه کنید.
آزمایش :چهل و هشتم
آزمایشی را طراحی کنید که بتوان مقدار بخار آب و کربن دی اکسید موجود درهوا را اندازه گیری کرد.
آزمایش :چهل و نهم
آزمایشی را طراحی کنید که به کمک آن بتوان گرمای سوختن اتانول را تعیین کرد.
آزمایش :پنجاهم
(( گرماسنجی ))
آ- 75 گرم آب را در گرماسنج ریخته و دمای تعادل اولیه ( Ө1 ) را یادداشت نمایید.
ب- 15 گرم آمونیم کلرید را با ترازو وزن کرده و به درون گرماسنج منتقل کنید.
پ- دمای تعادل نهایی محلول ( Ө2 ) را یادداشت کنید.
ت- آنتالپی انحلال را در آزمایش انجام گرفته محاسبه کنید.
ث- آنتالپی مولی انحلال آمونیم کلرید را محاسبه کنید.
ارزش آبی گرماسنج را برابر با 65j/c در نظر بگیرید. ( H = 1 , N = 14 , Cl = 35/45 g.mol-1 )
ج- دماهای تعادل اولیه و نهایی چه هنگام خوانده می شوند؟
آزمایش :پنجاه ویکم
(( شناسایی گونه ها و ترکیبات ))
پنج ترکیب KBr ، شکر، NaCl ، BaSO4 و KI در اختیار دارید. با توجه به وسایل و مواد موجود در روی میز کار:
آ- هریک از مواد را شناسایی کنید.
ب- نحوه شناسایی هر یک از ترکیبات فوق را در یک جمله بنویسید.
پ- در صورت وجود، معادلات شیمیایی مربوط به شناسایی ترکیبات را قید کنید.